治療轉移性大腸直腸癌,確立「治療目標」比用什麼藥物更重要,黑貓白貓會抓老鼠的才是好貓。
針對晚期(轉移性)大腸直腸癌治療,目前健保已給付不同的化學治療及標靶藥物,減輕病人負擔。一線標靶藥物的健保部分,可選擇使用血管新生抑制劑或表皮生長抑制劑的標靶藥物,需視病情情形決定。
| 血管新生抑制劑標靶藥物(如癌思停®) | 表皮生長抑制劑標靶藥物(如爾必得舒®) |
|
|
目前健保給付的標靶藥物主要有三種,其主要適應症與健保規範1,2,3整理如下:
| 標靶藥物 | 表皮生長抑制劑標靶藥物 | 血管新生抑制劑標靶藥物 | 多激酶抑制劑標靶藥物 |
|
注射方式 |
針劑 | 針劑 | 口服 |
| 適應症 |
與化學藥物合併使用,治療KRAS及NRAS原生型的轉移性大腸直腸癌病患 |
和化學療法併用,可做為轉移性大腸直腸癌患者治療 |
用於治療先前曾接受下列療法的轉移性大腸直腸癌患者,療法包括化療、血管新生抑制劑的標靶藥物等療法;若KRAS為原生型,則需接受過表皮生長抑制劑的標 靶藥物療法 |
| 健保規範 |
與化療合併使用治療具表皮生長因子受體表現型(EGFR expressing),KRAS基因及NRAS基因沒有突變之轉移性大腸直腸癌病患之一線治療 與化療合併使用,治療已接受過二線以上之化療失敗、具有表皮生長因子受體表現型且KRAS基因沒有突變的轉移性大腸直腸癌的病患 |
與化療合併使用,作為轉移性大腸或直腸癌患者的第一線治療 |
用於治療先前曾接受下列療法的轉移性大腸直腸癌患者,療法包括化療、血管新生抑制劑的標靶藥物等療法 若KRAS為原生型,則需接受過表皮生長抑制劑的標靶藥物療法 |
|
標靶藥物 |
表皮生長抑制劑標靶藥物 |
血管新生抑制劑標靶藥物 |
多激酶抑制劑標靶藥物 |
| 健保給付 |
每位病患健保僅給付一線或三線,若給付在一線以24週為限;三線僅18週為限 |
健保給付一線24週為限 |
主要給付於第三線或第四線,健保每次申請為8週 |
104年健保更通過給付口服多激酶抑制劑,可用於標準治療皆使用過但惡化後之第四線治療用藥; 若KRAS及NRAS基因突變型,則僅給付於接受過化療及表皮生長抑制劑的標靶藥物惡化後之第三線治療用藥3。
以下為美國國家癌症資訊網(NCCN)建議治療指引4及台灣健保給付5,6條件整理(2015/11):
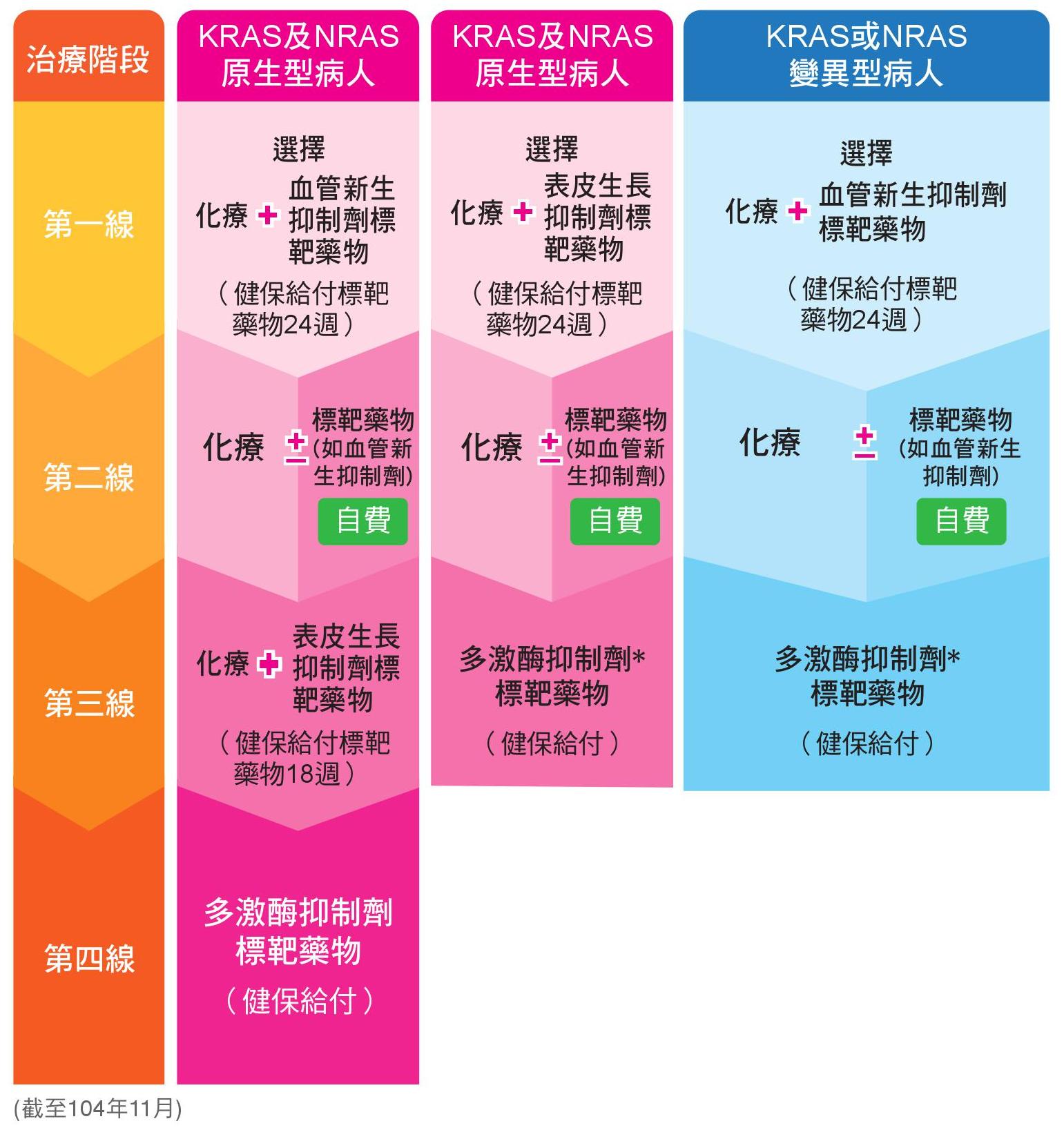
• 本表格依據目前NCCN治療建議及台灣目前健保給付條件以簡單方式呈現,詳細各藥品的健保給付規範,建議仍以健保局網站上所公告為準。
*多激酶抑制劑標靶藥物在第三線的健保給付條件須特別注意,若病人第一線以表皮生長抑制劑為標靶藥物,僅有在第二線曾有自費使用血管新生抑制劑標靶藥物的情況下,健保才得以給付第三線使用的多激酶抑制劑標靶藥物。且多激酶抑制劑標靶藥物的給付以每8週申請一次。
建議病人可以善用健保資源,與醫師討論適合的治療對策,既可兼顧經濟負擔,又可讓治療的好處得以延續。近幾年文獻也有指出,橫跨多線治療的概念,也就是說從一線後持續使用標靶藥物但僅於疾病惡化時更換併用之化療藥物以延長存活率。但是若有機會以治癒為前提,則要更深入討論。
參考資料:
- 健保給付抗癌瘤藥物 Antineoplastics drugs 9.27.Cetuximab(如Erbitux):(96/3/1、98/7/1、98/8/1、99/10/1、101/12/1、104/11/1) 附表七之三
- 健保給付抗癌瘤藥物 Antineoplastics drugs 9.37.Bevacizumab (如Avastin):(100/6/1)(101/05/1)附表九之十
- 健保給付抗癌瘤藥物 Antineoplastics drugs 9.51.Regorafenib(如Stivarga):(104/9/1)
- NCCN Guidelines Version 1. 2015 Colon Cancer
- 健保給付抗癌瘤藥物 Antineoplastics drugs 9.27.Cetuximab(如Erbitux):(96/3/1、98/7/1、98/8/1、99/10/1、101/12/1、104/11/1) 附表七之三
- 健保給付抗癌瘤藥物 Antineoplastics drugsn9.37.Bevacizumab (如Avastin):(100/6/1)(101/05/1) 附表九之十


